a) La chimiothérapie :
La chimiothérapie consiste à administrer des produits toxiques pour les cellules cancéreuses (dits « cytotoxiques », « cytostatiques » ou « antimitotiques » ). A la différence de la chirurgie, par exemple, il s’agit d’un traitement qualifié de « systémique » ou « général » parce qu’il concerne le corps entier, et non un organe particulier. Il a donc la capacité de détruire toute cellule cancéreuse, quelle que soit sa localisation dans l’organisme, qu’elle ait été repérée ou non par un examen.
Plus précisément, la chimiothérapie agit sur les cellules lorsqu’elles sont en train de se diviser afin de se multiplier. Les cellules cancéreuses ont en effet la particularité de se multiplier rapidement. Mais, par principe, cette action destructrice s’exerce aussi sur les cellules saines qui, de façon normale, se renouvellent rapidement dans le corps : principalement, les cellules de la moelle osseuse (qui produit les cellules sanguines), les cellules des cheveux, de la peau et de la muqueuse de la bouche. Ce phénomène explique certains effets secondaires bien connus de la chimiothérapie, comme la chute des cheveux par exemple mais aussi les atteintes du système immunitaire rendant les patients plus sensibles aux infections
Une chimiothérapie peut être commencée avant une intervention chirurgicale : il s’agit alors de chimiothérapie « néo-adjuvante ». Elle a souvent pour but de faciliter l’opération en diminuant préalablement le volume de la tumeur. Par exemple dans le cancer du sein, elle permet de pratiquer des opérations moins mutilantes.
La chimiothérapie est dite « adjuvante » lorsqu’elle est commencée après une opération chirurgicale. Elle a alors pour objectif d’éliminer les cellules cancéreuses qui seraient encore présentes dans le corps et qui n'ont pas été détectées par le bilan d'extension mais seraient capables de se manifester plusieurs années après la chirurgie en créant une rechute. Ce traitement adjuvant est en quelque sorte un traitement « préventif » de la rechute.
Enfin, en tant que traitement systémique, c’est-à-dire non localisé, la chimiothérapie est aussi un traitement essentiel de la maladie au stade métastatique, c’est-à-dire quand elle a quitté sa localisation d’origine pour migrer vers d’autres organes.
Il existe différents traitements de chimiothérapie en fonction de la nature des molécules-médicaments qui sont administrés. Les associations de molécules s’appellent des protocoles de chimiothérapie. Ces protocoles sont soigneusement encadrés et validés par les agences internationales de santé et reposent sur des données cliniques validées au niveau mondial.
Par ailleurs, si la majorité des tumeurs sont sensibles à l’action des chimiothérapies, on constate parfois qu’elles développent progressivement une résistance aux traitements. Les progrès visent alors à élaborer des stratégies thérapeutiques pour contourner ce phénomène : soit par la combinaison de plusieurs médicaments, soit par l’identification de marqueurs biologiques permettant de déterminer si une tumeur donnée est résistante à tel ou tel produit.
b) L’hormonothérapie :
La croissance de certains cancers est stimulée par des hormones. C’est le cas pour certains types de cancers du sein ou de la prostate par exemple. On dit de ces cancers qu’ils sont « hormonodépendants » ou « hormono- sensibles ». L’hormonothérapie consiste, dans ces cas là, à empêcher l’action stimulante des hormones sur les cellules cancéreuses. Elle permet ainsi d’empêcher le développement de ces tumeurs et leurs éventuelles métastases.
Il existe plusieurs techniques, qui peuvent être utilisées seules ou en association, en particulier :
- celles qui empêchent la fabrication des hormones impliquées dans la multiplication des cellules cancéreuses (en supprimant l’activité de la glande qui les produit par exemple, comme dans le cas d'une ablation des ovaires pour le cancer du sein)
- celles qui ont a recours à des anti-hormones qui prennent la place de l’hormone naturelle au niveau des récepteurs hormonaux des cellules. C’est, par exemple, le mécanisme d’action du tamoxifène, une molécule largement utilisée dans le traitement du cancer du sein.
c) L’immunothérapie :
L’immunothérapie vise à remplacer ou modifier les défenses naturelles du corps humain. Elle est fondée sur l’idée que le système immunitaire puisse voir les cellules cancéreuses comme des « étrangères » et qu'il deviendra donc susceptible de les éliminer.
Plusieurs stratégies sont envisageables :
- l’immunothérapie dite « active » revient à stimuler, sur le principe de la vaccination, les défenses immunitaires du patient.
- l’immunothérapie dite « adoptive » consiste à greffer au patient des cellules destinées à agir contre les cellules cancéreuses. Jusqu’à présent, cette stratégie n’a démontré son utilité que dans certains cancers hématologiques (cancers du sang).
- l’immunothérapie appelée « passive » consiste à injecter, dans l’organisme du patient, des anticorps dirigés contre les cellules cancéreuses. Ces anticorps pourront aussi recruter les cellules du système immunitaire ("lymphocytes tueurs")
d) Les thérapies ciblées :
Le terme « thérapies ciblées » désigne des nouveaux traitements qui, comme leur nom l’indique, consistent à « cibler » précisément certaines caractéristiques biomoléculaires des cellules cancéreuses (voir interview en Annexe 2 de ce document). Les progrès de la connaissance en biologie des tumeurs ont en effet permis d’identifier avec précision le rôle joué par un certain nombre de molécules dans le développement d’un cancer et de ses métastases. En s’attaquant à ces molécules, les thérapies ciblées visent à une plus grande efficacité et, parce qu’elles sont moins dirigées vers les cellules saines qui sont moins porteuses de ces biomarqueurs, entraînent moins d’effets secondaires que les chimiothérapies classiques.
Dans ce domaine thérapeutique en plein développement, plusieurs types de « cibles » peuvent être visés par les traitements :
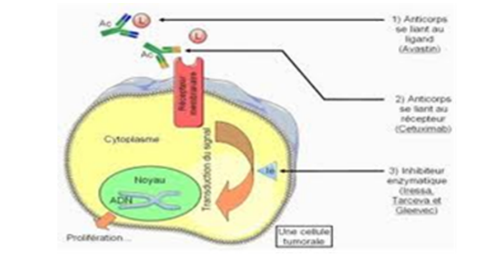
Figure 7 : Stratégie d'inhibition de la prolifération tumorale.
Comme le montre la Figure 7, la thérapie ciblée agit à plusieurs niveaux :
- l’anticorps se lie au récepteur exprimée à la surface des cellules cancéreuses: cette fois le ligand naturel ne pourra pas se lier au récepteur car il devient inaccessible (ex : Cetuximab, anticorps monoclonal qui se lie à un facteur de croissance épidermique humain (EGFR) et sa liaison entraine la non activation des signaux intracellulaires)
- l’anticorps se lit au ligand naturel de la protéine récepteur exprimée à la surface des cellules cancéreuses : ainsi le ligand spécifique ne pourra pas se fixer au domaine de liaison du récepteur (ex : Bevacizumab, anticorps monoclonal dirigé contre le ligand VEGF entrainant une réduction de la croissance des micro-vaisseaux sanguins nourrice indispensable à la croissance de toute tumeur et au développement des métastases)
- des inhibiteurs enzymatiques bloquent la transduction du signal générée par la liaison du ligand avec le récepteur (ex : Glivec®)
Remarque : les médicaments en référence à un anticorps monoclonal se termine par les trois lettres « mab » qui signifie en anglais « monoclonal antibody ».
Cette liste n’est pas exhaustive car, au fur et à mesure des découvertes, de nouvelles cibles viennent s’y ajouter. Actuellement des dizaines de molécules sont testées en Développement. Les thérapies ciblées ont profondément modifié la prise en charge de certains types de cancer.
Ainsi par exemple, le Glivec® a révolutionné le traitement de deux formes de cancer. Pour les patients atteints de tumeur stromale digestive qui touche plus d’un millier de personnes chaque année en France, le taux de survie un an après le diagnostic était de seulement 30% avant l’apparition du Glivec®, il est de 90% aujourd’hui. Pour les patients atteints de leucémie myéloïde chronique (plusieurs centaines de nouveaux cas par an en France), le taux de survie 5 ans après le diagnostic était d’environ 35%, il est aujourd’hui de 90%.
Autre exemple, pour une certaine forme de cancer du sein, dite HER2+( c’est à dire dont les cellules tumorales sur-expriment à leur surface un récepteur appelé HER2), qui représente 15 à 20% des cancers précoces du sein. L’Herceptin® (trastuzumab), en traitement adjuvant après une chimiothérapie, a permis de faire baisser significativement le risque de décès au bout d’un à deux ans de traitement (- 33%).

Ajouter un commentaire