a) La radiographie photographie les structures denses en 2D :
Des rayons X émis par un tube émetteur, traversent le corps humain et sont plus ou moins absorbés par les tissus en fonction de leur densité. Ils impriment un film photographique placé à l’opposé du patient. Afin d’opacifier certaines structures creuses, des produits de contraste sont souvent injectés.
Pour réduire les doses de rayons émises lors des examens, les films radiographiques sont aujourd’hui, souvent remplacés par des détecteurs électroniques qui numérisent directement les images et sont plus sensibles que les plaques.
La radiographie (mammographie) est la technique d’imagerie de première intention pour la détection du cancer du sein.
b) Le scanner (ou tomodensitométrie) permet d’observer des organes et tissus en 3D :
Le scanner repose également sur l’utilisation des rayons X mais permet d’obtenir des images tridimensionnelles des organes ou des tissus sous forme de coupes ce qui permet de repérer des anomalies de structure jusqu’alors confondus sur des clichés radiographiques classiques en 2D.
En pratique (Figure 3), un tube émetteur de rayons X tourne à très grande vitesse autour du patient et prend une succession d’images du corps à 360°. Des capteurs qui entourent le patient mesurent l’absorption des différents tissus.
Le scanner permet donc de mieux localiser les tumeurs que la radiographie classique facilitant ainsi les biopsies : il permet aussi de contrôler la réponse à la chimiothérapie.
Comme pour la radiographie, un produit de contraste le plus souvent à base d'iode, opaque aux rayons X, peut être nécessaire pour mieux visualiser des tumeurs qui pourraient se confondre avec certains tissus avoisinants.
Le scanner comme la radiographie sont des techniques d’imagerie par transmission (un faisceau externe traverse le patient).
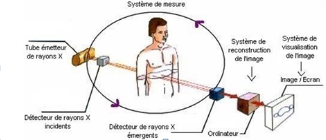
Figure 3 : schéma de fonctionnement des rayons X au sein du scanner.
c) L’imagerie par résonance magnétique (IRM), une technique très précise pour observer les lésions et les tissus :
L'imagerie par résonance magnétique nucléaire (IRM) est utile pour visualiser différentes structures et en particulier des "tissus mous" tels que le cerveau, la moelle épinière, les viscères, les muscles et les tumeurs avec des contrastes plus élevés que la tomodensitométrie.
C’est un examen justifié lorsqu’un doute persiste après des radiographies ou un scanner.
L'IRM repose sur le principe de la résonance magnétique : lorsqu’ils sont soumis à un champ magnétique, les protons des noyaux atomiques changent d’orientation puis reviennent à leur position initiale en émettant un signal. Ils se réalignent plus ou moins rapidement en fonction de la densité des tissus. Une caméra spéciale capte ces signaux et les convertit en image. En pratique, une bobine magnétique est placée autour du patient et balaye la zone du corps à étudier en créant un champ magnétique. Il s’agit d’une technique non invasive.
d) La scintigraphie et la tomographie par émission de positons (TEP), utiles au diagnostic :
La découverte de la radioactivité a conduit au développement de la médecine nucléaire avec la scintigraphie puis la tomographie par émission de positons (TEP) dans les années 1990.
La scintigraphie consiste à injecter au patient un radiotraceur ( généralement association d’une molécule vectrice et d’un marqueur radioactif). Ce radiotraceur en émettant un rayonnement gamma détectable par une « gamma-caméra » permet une localisation précise de la molécule dans l’organisme.
La scintigraphie est généralement utilisée dans l’exploration de la thyroïde, du squelette (scintigraphie osseuse), en cardiologie (tomoscintigraphie myocardique) et aussi très fréquemment en cancérologie.
La TEP (tomographie par émission de positons ou PET en anglais), utilise des radioéléments qui émettent deux rayonnements diamétralement opposés. Un détecteur, placé tout autour du patient, capte les signaux qui coïncident et restitue une image d’excellente définition. Cette technique est surtout utilisée en cancérologie.
Le PET Scan comme son nom l’indique combine la TEP et le scanner. Il s’git d’une technologie très récente et apparait comme un outil fondamental de dépistage et de suivi du cancer (Figure 4 à 6).
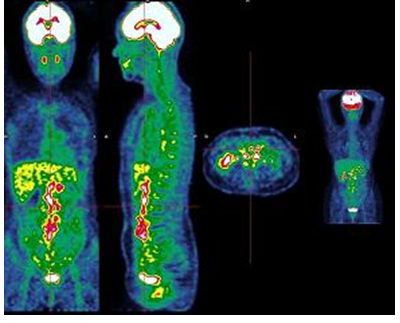
Figure 4 : Image PET avec zones d’hypermétabolisme (colorées) pathologique mais structure anatomique pas clairement affirmée.
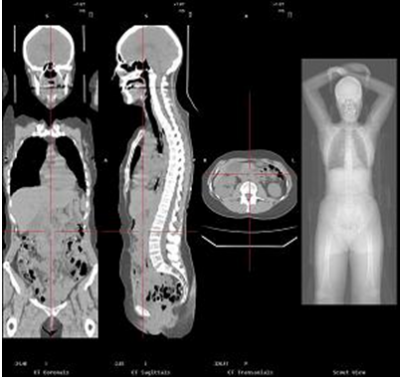
Figure 5 : Image scanner offrant une étude anatomique précise.
Ainsi, la TEP repère les cellules ayant un métabolisme anormal, particulièrement les cellules cancéreuses et le scanner permet de situer les images obtenues à la TEP dans leur environnement anatomique. Il profite donc des fonctions de ces deux formes d'imagerie et les assemble.
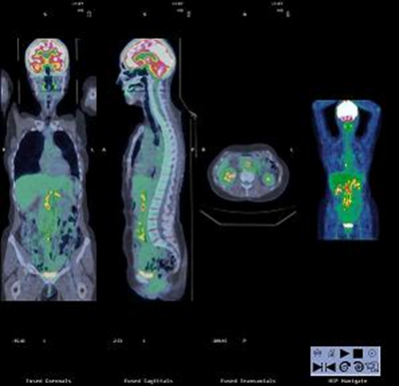
Figure 6 : Image PET Scan combinant les avantages des deux technologies.
La France possède plusieurs PET Scan qui couplent ces deux techniques. Le radioélément utilisé dans le dépistage et le suivi du cancer est le désoxy-D-glucose marqué au fluor 18 de courte durée de vie (110 minutes environ).
Cet analogue du glucose est davantage consommé par les cellules cancéreuses actives que par les cellules saines, ce qui permet d’observer des "points chauds" dans l’organisme et ainsi de dépister des tumeurs ou métastases. L’atout de la technique est de fournir une estimation du volume de la tumeur mais également de son niveau d’activité tumorale.
Le PET scan est une technique d’imagerie dite fonctionnelle car elle permet de visualiser les activités du métabolisme des cellules par opposition aux techniques d’imagerie structurelles comme celles basées sur les rayons X qui réalisent plutôt des images de l’anatomie.
Ces dernières décennies ont donc été concrétisées par des progrès permanents dans les techniques d’imagerie :
- La rapidité d’acquisition des images : la durée des examens ne cesse de se réduire grâce à des logiciels qui enregistrent des dizaines d’images en même temps et les reconstruisent simultanément. Cela améliore bien sûr le confort des patients. Radiographies, scanners et scintigraphies sont aujourd’hui effectués en quelques secondes ou minutes.
- La sécurité : l’objectif de tous les constructeurs est de réduire les doses de rayons X et de radioéléments. Pour cela, ils développent des détecteurs ultra sensibles qui permettent de maintenir une image de très bonne qualité.
- La qualité de l’image : accroître régulièrement la sensibilité et la résolution des appareils afin d’améliorer la qualité des images. Dans cet esprit, par exemple, les champs magnétiques utilisés en IRM sont de plus en plus puissants. Deux appareils fonctionnent en France avec des champs de 7 Tesla contre 3 Tesla en général.
- Améliorer le diagnostic : les scientifiques recherchent sans cesse de nouveaux radiotraceurs à utiliser en scintigraphie afin d’étudier davantage de maladies et d’organes.

Ajouter un commentaire